Moleküllerin Üç Boyutlu Dünyası: Moleküler Geometri ve Molekül Şekilleri
- Emre Can Buluz

- 3 Nis 2025
- 6 dakikada okunur
Güncelleme tarihi: 10 Haz 2025
Moleküllerin üç boyutlu yapısı, kimyasal ve biyolojik özelliklerini belirleyen en önemli faktörlerden biridir. Moleküler geometri, atomların uzaydaki düzenlenişini ve bağ açılarını inceleyen bir alandır. Bu geometri, atomların hibritleşme durumları, bağ türleri ve merkezi atomun etrafındaki elektron çiftleri gibi faktörlere bağlı olarak değişmektedir. VSEPR (Valence Shell Electron Pair Repulsion – Değerlik Kabuğu Elektron Çifti İtme) teorisi gibi modeller, molekül şekillerini tahmin etmek için yaygın olarak kullanılmaktadır.
VSEPR Modeli
VSEPR modelinin kullanımına ilişkin iki genel kural vardır:
Elektron çifti itmesi açısından, çift bağlar ve üçlü bağlar tek bağlar gibi ele alınabilir. Bu yaklaşım, niteliksel amaçlar için iyi bir yaklaşımdır. Ancak, gerçekte çoklu bağların tek bağlardan daha "geniş" olduğunu unutmamak gerekir; yani iki atom arasında iki veya üç bağ bulunduğunda, elektron yoğunluğu daha fazla alan kaplar.
Eğer bir molekülün iki veya daha fazla rezonans yapısı varsa, VSEPR modelini herhangi birine uygulayabiliriz. Genellikle formal yükler gösterilmez (1).
VSEPR modeline göre bir atomun değerlik kabuğunda yalnızca iki elektron çifti varsa bu çiftler birbirlerini en az seviyede itmek için çekirdekten mümkün olduğunca uzak konumlanır. Bu durum, elektron çiftlerinin doğrusal (linear) düzenleme almasına neden olur. Yani elektron çiftleri, birbirine 180° açıyla yerleşmiş alanları işgal eder (Şekil 1.).

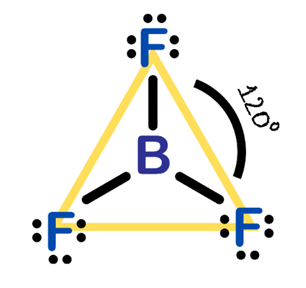
Eğer bir atomun değerlik kabuğunda üç elektron çifti bulunuyorsa bu çiftler, eşkenar üçgenin köşelerine yönelerek düzlemde düzenlenme eğilimindedir. Bu düzenlemeye trigonal düzlemsel (trigonal planar) denir ve burada elektron çiftlerinin işgal ettiği bölgeler 120° açılarla birbirine yönelmiştir (2) (Şekil 2.).
Bir atomun değerlik kabuğunda dört elektron çifti olduğunda bu çiftler tetrahedral düzen alır. Yani, atomu düzgün bir tetrahedronun merkezinde olarak hayal ederseniz her bir elektron çifti genellikle bir köşeye (veya tepe noktasına) doğru yönelir. Bu durumda, elektron çiftlerinin işgal ettiği bölgeler yaklaşık 109.5° açılarla birbirine yönelmiştir (Şekil 3.).

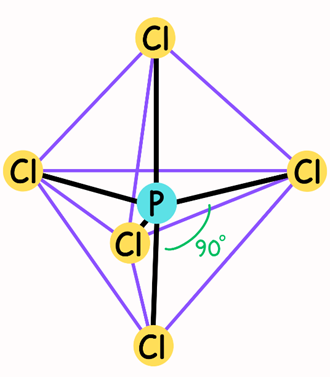
Fosfor gibi büyük atomlar sekizden fazla değerlik elektronu barındırabilir. Fosfor pentaklorür (PCl₅) molekülündeki fosfor atomu, değerlik kabuğunda beş elektron çiftine sahiptir. Fosforun çevresinde beş bağlanma çifti olduğunda PCl₅ molekülü trigonal bipiramidal geometriye sahip olmaktadır. Ancak trigonal bipiramidal yapının tüm köşeleri eşit değildir yani, elektron çiftleri arasındaki açılar tamamen aynı değildir. Bu nedenle, elektron çiftlerinin yöneldiği doğrultular birbirine denk değildir. Bu doğrultulardan iki tanesi, eksenel (axial) doğrultular olarak adlandırılır ve merkezi atom boyunca bir eksen oluşturur. Bu eksenel doğrultular birbirinden 180° açıyla ayrılmıştır.
Diğer üç doğrultu ise ekvatoryal (equatorial) doğrultular olarak adlandırılır. Bu doğrultular, merkezi atomdan geçen ve eksenel doğrultulara dik (90°) olan bir düzlem üzerinde yer alan eşkenar üçgenin köşelerine yönelmiştir. Ekvatoryal doğrultular, birbirlerinden 120° açıyla ayrılmıştır (Şekil 4.) (2).
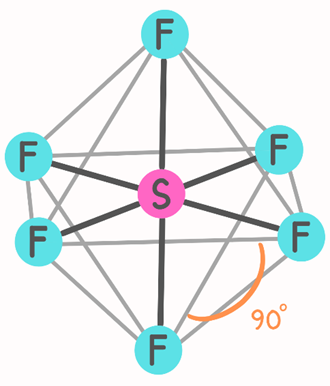
Altı S–F bağının en kararlı düzenlenişi, oktahedral (octahedral) bir şekildedir (Şekil 5.). Oktahedron sekiz yüzeye sahiptir. Bu yapı, ortak bir tabana sahip iki kare piramidin birleştirilmesiyle oluşturulur. Bu durumda merkezi atom (yani kükürt, S) karenin merkezinde çevresindeki atomlar ise altı köşede bulunur. Tüm bağ açıları 90°'dir ancak merkezi atom ile çapraz olarak zıt yönlerde bulunan atom çiftleri arasındaki bağ açısı 180°'dir. Oktahedral molekülde altı bağın tümü eşdeğer olduğu için, trigonal bipiramidal moleküllerde olduğu gibi eksenel (axial) ve ekvatoryal (equatorial) terimlerini kullanılamamaktadır (Şekil 5.) (1).
Hibritleşme ve Molekül Geometrisi Arasındaki İlişki
Hibritleşme ve molekül geometrisi arasındaki ilişki, atomların bağ yapısını ve uzaysal düzenini anlamada temel bir kavramdır. Hibritleşme, atomların enerji düzeylerindeki orbitallerin karışarak yeni hibrit orbitaller oluşturması sürecidir ve bu orbitallerin yönelimi, molekülün geometrisini belirlemektedir.
sp³ Hibritleşmesi
Hibrit orbitaller, farklı orbitallerin karıştırılmasıyla oluşan yeni orbitallerdir. Bu orbitallerin birleşimi fikri, Linus Pauling tarafından 1931 yılında ortaya atılmıştır (3). Eğer karbonun ikinci kabuğundaki bir s ve üç p orbitali birleştirilerek dört eşit orbitale bölüştürülürse ortaya çıkan her bir orbital bir parça s ve üç parça p karakterine sahip olur. Bu tür bir hibrit orbital sp³ hibrit orbitali olarak adlandırılır. Her bir hibrit orbital %25 s karakterine ve %75 p karakterine sahiptir. Bu dört orbital eş enerjili (dejeneredir) yani aynı enerji seviyesine sahiptir (4).

Bir p orbitali gibi bir sp³ hibrit orbitali de iki lobludur. Ancak bu loblar büyüklük açısından farklıdır; çünkü s orbitali, p orbitalinin bir lobuna katkıda bulunurken diğer lobundan çıkar. Bağ oluşumunda, hibrit orbitalin büyük lobu kullanılır.
sp2 Hibritleşmesi
Üç atomla bağ yapabilmek için her karbon üç atomik orbitalini hibritler. Üç orbital (bir s orbitali ve iki p orbitali) hibritleştiğinden, üç hibrit orbital elde edilir. Bu orbitaller sp² hibrit orbitalleri olarak adlandırılır.sp² hibritleşmiş karbon atomu, bir düzlem tanımlayan üç atoma bağlandığı için trigonal planör karbon olarak adlandırılır. Hibritleşmemiş p orbitali ise sp² orbiterlerinin eksenleriyle tanımlanan düzleme dik bir konumda bulunur. Etenin karbonları, birbirleriyle iki bağ oluşturur. Buna çift bağ denir. Çift bağdaki iki karbon-karbon bağı aynı değildir. Bağlardan biri, bir karbonun orbitali ile diğer karbonun orbitali arasındaki örtüşmeden oluşur; bu, sigma bağıdır çünkü uçtan uca örtüşme ile oluşur. Her karbon, diğer iki orbitalini kullanarak hidrojenin s orbitali ile örtüşerek bağları oluşturur. İkinci karbon-karbon bağı ise iki hibritleşmemiş p orbitalinin yan yana örtüşmesinden oluşur. Yan yana örtüşme ile oluşan p orbital bağlarına pi bağı denir (4).

İki p orbitali, pi bağı oluşturacak şekilde en fazla örtüşme için birbirlerine paralel olmalıdır. Bu, bir karbon ile iki hidrojenin oluşturduğu üçgenin, diğer karbon ve iki hidrojenin oluşturduğu üçgenle aynı düzlemde olmasını zorunlu kılar. Bu da, etenin altı atomunun hepsinin aynı düzlemde olduğu anlamına gelir ve p orbitallerindeki elektronlar bu düzlemin üzerinde ve altında bir alanı doldurur (4).
sp Hibritleşmesi
Etin (asetilen olarak da adlandırılır) molekülündeki karbon atomlarının her biri yalnızca iki atoma bir hidrojen ve bir diğer karbona bağlıdır. Her karbon, iki atom ile kovalent bağ oluşturduğundan yalnızca iki orbital (bir s ve bir p) hibritleşir. Bunun sonucunda iki eşdeğer sp orbitali oluşmaktadır. Bu nedenle, etindeki her karbon atomu iki sp orbitali ve iki hibritleşmemiş p orbitali bulundurur. Etindeki bir karbonun sp orbitallerinden biri, diğer karbonun sp orbitali ile örtüşerek karbon-karbon sigma bağını oluşturur. Her karbonun diğer sp orbitali ise bir hidrojenin s orbitaliyle örtüşerek karbon-hidrojen sigma bağını oluşturur.
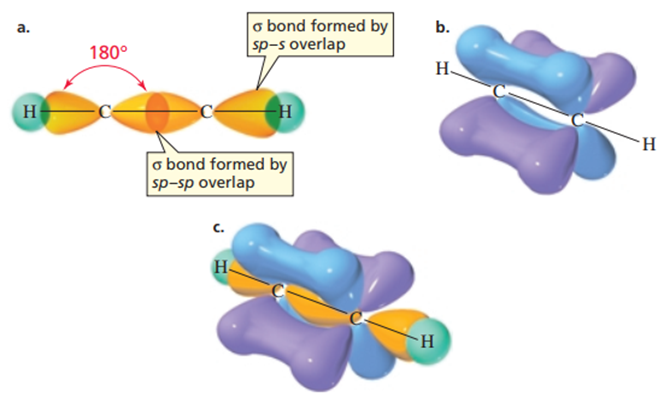
Elektron itmesini en aza indirmek için iki sp orbitali zıt yönlere doğrultulmuştur. Sonuç olarak, bağ açıları 180°'dir. Hibritleşmemiş iki p orbitali birbirine dik konumdadır ve her ikisi de sp orbitallerine dik olarak yer alır. Hibritleşmemiş her bir p orbitali, diğer karbondaki paralel bir p orbitali ile yan yana örtüşerek birer pi bağı oluşturur. Sonuç olarak, bir sigma bağı ve iki pi bağı içeren üçlü bir bağ meydana gelir. Her karbondaki iki hibritleşmemiş p orbitali birbirine dik olduğundan molekülün çekirdekler arası ekseni etrafında üstünde, altında, önünde ve arkasında yüksek elektron yoğunluğuna sahip bölgeler oluşur. Etin molekülü için oluşturulan potansiyel haritası, negatif yükün yumurta şeklindeki molekülü saran silindirik bir bölgede biriktiğini göstermektedir (4).
Sonuç olarak, hibritleşme, moleküler geometri ve molekül şekilleri arasındaki ilişki, kimyasal bileşiklerin üç boyutlu yapısını ve davranışlarını anlamada kritik bir rol oynar. Bir atomun hibritleşme türü, bağların uzaydaki yönelimini belirleyerek molekülün geometrisini şekillendirir ve bu da molekülün fiziksel ve kimyasal özelliklerini doğrudan etkiler. VSEPR teorisi çerçevesinde değerlendirildiğinde, elektron çiftleri arasındaki itme kuvvetleri de molekülün son şeklini belirleyen önemli bir faktördür. Bu nedenle, moleküllerin reaktivitesi, polaritesi ve etkileşimleri gibi özelliklerini anlamak için hibritleşme, moleküler geometri ve molekül şekilleri birlikte ele alınmalıdır.
Referanslar
1. Raymond Chang, Jason Overby. (2011). General Chemistry: The Essential Concepts. McGraw-Hill.
2. Darrell Ebbing, Steven D. Gammon. (2007). General Chemistry: Media Enhanced Edition. Cengage Learning.
3. Linus Pauling. (1931). The nature of the chemical bond. Application of results obtained from the quantum mechanics and from a theory of paramagnetic susceptibility to the structure of molecules. J. Am. Chem. Soc. 53.
4.Bruice, Paula Yurkanis. (2004). Organic Chemistry. Upper Saddle River, NJ :Pearson/Prentice Hall.




Yorumlar