PCR: Moleküler Biyolojide Devrim Yaratan Teknik
- Muhammed Furkan Üstün

- 9 Tem
- 6 dakikada okunur
Son yüzyılda biyoloji ve moleküler genetik bilimlerinin inanılmaz derecede ilerlemesi ve gelişmesiyle beraber azımsanmayacak düzeyde genetik veri elde edilmiş ve biriktirilmiştir. Bununla birlikte teknolojinin de gelişmesiyle bu yüksek miktardaki genetik verilerin hem işlenmesini hem de depolayarak farklı kullanıcıların bu verileri kullanılmasına olanak sağlayan bir interdisipliner bilim dalı haline gelmiştir (1). Buna örnek vermek gerekirse, 1986’da genomik veriler (nükleotid dizileri) ortalama 9980 bandındayken, 2001 yılında 14.976.310’a günümüzde ise bu oran, 4.7 milyar civarına ulaşmış ve hızla artarak devam etmektedir (2,3). Bu konuyla ilgili farklı detaylara ulaşmak isterseniz “Biyoinformatiğe Giriş ve Temel Kavramlar” yazımıza göz atmanızı tavsiye ederiz. Değerli bilimseverler, bu yazımızda ise biyoinformatik biliminin ortaya çıkışında büyük role sahip olan PCR (Polimeraz Zincir Reaksiyonu)’nu ele alacağız.
Polimeraz Zincir Reaksiyonu (PCR)
PCR, DNA içerisinde bulunun iki lokus arasındaki dizisi bilinen özgün bir bölgenin enzimatik yollarla kopyalanması ve yeniden çoğaltılması için kullanılan ve üç aşamadan (ayrılma, birleşme ve uzama) meydana gelen, in vitro bir biyoteknolojik işlemidir. Bu yöntem ilk olarak Kjell Klape tarafından bulunmuş ve uygulanmıştır. Ancak o dönemde kullanılan materyallerin sıklığı ve hata oranın yüksek olması ki bunlar arasında en önemli olanı, DNA polimeraz enziminin (nükleotidleri eşleniğiyle birleştirerek dizinin uzamasını sağlar) her “Ayrılma” aşamasında yüksek sıcaklığa (90-93°C) maruz kalmasından dolayı denatüre olmuştur. Bu sebeple her döngüde yeniden DNA polimeraz enziminin eklenmesini zorunlu kıldığı için çalışmanın hata oranı da bununla birlikte artmıştır. Ancak 1985 yılında Kary Mullis tarafından sıcaklığa dayanıklı arkelerden (Thermus aquaticus) izole edilen Taq polimeraz enziminin, PCR’da sorunsuz bir şekilde annealing yani DNA dizilerinin uzamasını sağlamasıyla, PCR denilen “Polimeraz Zincir Reaksiyonu” teknolojisi ortaya çıkmıştır. Bu keşfi, Kary Mullis’e 1993 Nobel Kimya Ödülü’nü kazandırmıştır (4).

PCR, DNA klonlaması için seri bir tekniktir ve bu nedenle rekombinant DNA araştırmalarının gücünü artırarak DNA klonlamasındaki konak hücre gereksinimlerini ortadan kaldırmıştır. PCR, farklı DNA moleküllerinden oluşan bir popülasyonda veya örnekte, yok denecek kadar az olan bir DNA dizisini, seri olarak in vitro reaksiyonla kopyalayarak çoğaltmaktadır (her döngüde DNA miktarını 2n kadar artırmaktadır). Ancak PCR’ın hatasız bir şekilde meydana gelmesi için uygun PCR materyallerinin bulundurulması ve kullanılması gerekmektedir. Bu materyaller;
· DNA Örneği
· Primerler (İleri, Geri olmak üzere iki adettir)
· dNTP (dATP, dTTP, dGTP, dCTP)
· Taq Polimeraz Enzimi
· Tampon ve İyon Çözeltiler
· Nükleaz-DNase-Free Su şeklindedir.
Ayrıca istenen özgül bölgenin çoğaltılması için o lokusa ait tanımlayıcı unsur olan “Primerler” tasarlanmalıdır. Primerler, ortalama 18-24 nükleotid uzunluğunda olan kısa DNA dizileridir. Bu primerler çoğaltılacak bölgelerin 5’-3’/3’-5’ uçlarını tanıyarak, PCR döngüsü sırasında ilgili bölgeye yerleşerek dizinin kalanın oluşmasını sağlamaktadırlar. Böylelikle hedef DNA bölgesini tek seferde 2 katına çıkaran, tam bir reaksiyon işlemine PCR’da bir döngü olarak adlandırılmaktadır. Bu şekilde sadece birkaç saat içerisinde mevcut DNA miktarı her döngüde 2 katına çıkarak artmaktadır (4).

Çoğaltılan DNA miktarı sistematik olarak tekrarlanan döngü sayısı ve tüp içerisinde bulunan materyaller kadardır. Ancak birkaç faktör DNA dizisinin çoğalmasını veya hatasız dizi oluşmasını engellemektedir. Sık olarak kullanılan PCR çalışmaları üç döngüden meydana gelmektedir ve bu döngülerde meydana gelecek herhangi bir hatanın kalan dizileri de olumsuz etkileyeceği aşikardır. Bu üç basamak şu şekildedir:
Denatürasyon: Klonlanması için seçilen çift zincirli DNA, primerlerin bağlanıp uzaması için tek zincire indirilmelidir. Bu sebeple denatüre edilir. Bunun içinde çift zincirli DNA’nın 92-95°C’de yaklaşık olarak 1 dk civarı ısıtılması onu tek zincirli hale getirmektedir (4).
Hibridizasyon/Tutunma (annealing): Denatürasyon aşamasıyla birlikte DNA tek zincirli hale gelir. Daha sonra reaksiyon sıcaklığı 45-65°C arasında bir değere düşürülür. Daha sonra önceden hazırlanmış olan ve çoğaltılmak istenen bölgeye ait primerler ise eşleniği olan uçlara yerleşir. Daha sonra Taq polimeraz enzimleri sayesinde uzama aşamasında primerler referans alınır ve uzama aşaması başlar. Bu basamağa hibridizasyon denmektedir (4).
Uzama: Hibridizasyon aşamasından sonra eşlenik uçlara yerleşen primerlerin uzayıp istenen bölgeyi çoğaltması için Taq polimeraz denen enzimlerin çalışması gerekir. Bunun için de ortam sıcaklığı 65-75°C aralığına getirilir. Bu işlemle beraber enzim her nükleotidin karşılığı olan bazları sırasıyla diziye ekleyerek 5’ ucundan 3’ ucuna doğru uzayarak yeni kopyayı sentezler (4).

Şekil 3.’te görüldüğü üzere PCR sonrası elde edilmiş olan Van Kedisi cDNA’sının “Agaroz Jel Elektroforez” uygulaması sonucu varlığını görmektesiniz. İşaretli alan içerisinde kalan parlak çizgiler bizlere DNA’nın uygulama sonucunda verilen akıma dayanarak jel içerisinde hareket ettiğini göstermektedir. Ancak burada bulunan cDNA herhangi bir primerle kopyalanmadığı ve büyük bir diziye sahip olduğu için tam haliyle çoğaltılıp kalmıştır. Bu nedenle verilen akım sonucu kısıtlı düzeyde hareket etmiştir.
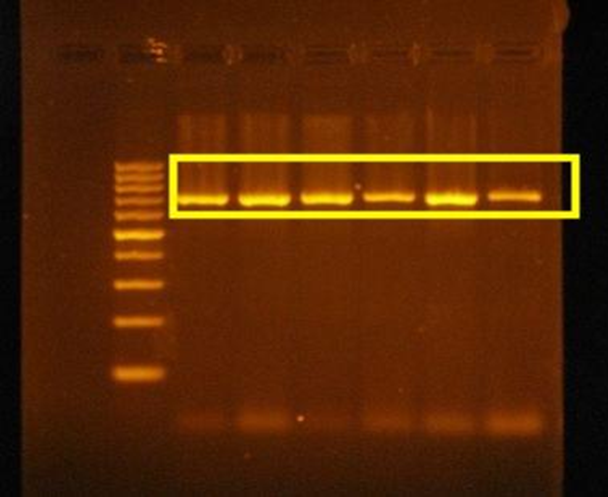
Şekil 4.’te görüldüğü üzere, Van Kedisi genomunun primer kullanılarak yapılmış bir PCR çalışmasını görmektesiniz. Bu çalışma, ilgili gen bölgesine ait olan ve önceden tasarlanmış primerlerin, gen bölgelerine yerleşerek PCR’da çoğaltılmış ve daha sonra bu bölgenin özgünlüğünün tespit edilmesi için tekrardan “Agaroz Jel Elektroforez” uygulamasına tabi tutulmuştur. Sonuçlarda ise sarı alan içerisinde kalmış olan bölgeler, primerlerin ilgili gen bölgelerine hatasız bir şekilde yerleştiği ve daha sonrasında çoğaltılarak, gen boyutunu kazandığını göstermektedir.
PCR tekniğinin keşfinden sonra günümüze kadar birçok yeni yöntemi de ortaya çıkmıştır. Bu yöntemler kendi içinde farklılık gösterse dahi ana amaç her zaman istenen bölgenin özgün kopyalarını üretmektir. Bu metotlar sırasıyla; Nested-PCR, Real-Time PCR, Multipleks PCR, Reverse PCR, Touchdown PCR şeklindedir.
Nested-PCR
Bu yöntem PCR’ın spesifikliğini, yani istenen bölgenin özenli bir şekilde hatasız olarak çoğaltılmasını hedeflemektedir. Bunun için iki aşamalı bir PCR tekniği uygulanır. İlk olarak çoğaltılması istenen bölgenin dışından dizi seçilerek amplifikasyon yapılır. Daha sonra çoğaltılan dış bölgenin içerisinden asıl amplifike edilecek dizi seçilir ve tekrar PCR yapılarak özgün bölge kopyalanır. Ancak bu yöntemde iki adet PCR yapılması için ilk önce geniş olan diziye ait olan primerler tasarlanır. Daha sonra asıl amplifike edilecek iç bölge için de o bölgeye özgün primer tasarlanır ve PCR uygulanır. Bu yöntem sayesinde çoğaltılmak istenen bölge daha özgün ve hata oranı düşük bir şekilde çoğaltılabilir (6).
Real-Time PCR
Bu yöntem araştırmacıya bir deney esnasında yapılan PCR ürününün miktarını gerçek zamanlı olarak sunmaktadır. Bu yöntemde tüp içerisine döngülü olarak floresan ışınlar gönderilerek çoğalması istenen bölgenin hangi düzeyde çoğaldığı analiz edilerek, kullanıcıya eş zamanlı olarak sunmaktadır. Standart PCR yönteminde tüm işlemler anlık olarak takip edilemez. Çünkü istenen PCR ürünü ancak PCR işleminden sonra, Jel Elektroforez yöntemiyle ölçülebilir. Fakat Standart PCR’dan farklı olarak Real-Time PCR, her döngü sonunda gönderilen floresan ışımalar ile tüp içerisinde çoğalan DNA miktarı ölçülebilmektedir (4).
Multiplex PCR
Bu yöntem kalıp DNA’yı, yani genomun tamamını PCR’da çoğaltmak için uygulanmaktadır. Bunun için DNA dizisi boyunca birden fazla bölgenin primer çiftleri tasarlanır ve dizi boyunca kullanılır ve DNA bu şekilde kısa sürede çoğaltılır. Bu sistem “Okazaki Parçaları” olarak da düşünülebilir. Bu metot sayesinde kısa dizili virüsler ve bakteriler kolay bir şekilde çoğaltılarak tanımlanabilir (7,8).
Reverse Transkriptaz PCR
Bu yöntem standart PCR’dan farklı olarak, genomik materyali RNA olan retrovirüslerdeki RNA çoğaltımı mantığını kullanır. Bu virüslerden izole edilen Revers Transkriptaz enzimi yardımıyla, RNA'dan tamamlayıcı DNA (cDNA) sentezi gerçekleştirilir. Bu metot sayesinde gen ekspresyonu, kolay ve hızlı bir şekilde yapılabilmektedir. Retrovirüslerden izole edilen enzim sayesinde RNA kalıp olarak kullanılarak hedef genoma ait DNA sentezlenir, daha sonra sentezlenen DNA-RNA sarmalı ayrılması sağlandıktan sonra, elde edilen DNA dizisi referans alınarak çifti zincirli DNA elde edilir ve çoğaltılır (9).
Touchdown PCR
Touchdown PCR (TD-PCR), klasik PCR protokolüne göre özgüllüğü artırmak amacıyla geliştirilmiş bir polimeraz zincir reaksiyonu tekniğidir. Özellikle primerlerin hedef DNA'ya özgül olarak bağlanmasını sağlamak için tercih edilir. Bu yöntem, PCR sırasında kullanılan annealing (eşleşme) sıcaklığının, ilk döngüde normal sıcaklığında üstüne çıkarıp her birkaç döngüde kademeli olarak düşürülmesi esasına dayanır. Bu sıcaklık, primerlerin sadece tamamen tamamlayıcı dizilere bağlanabileceği düzeydedir. Daha sonra bu sıcaklık, her birkaç döngüde 1–2°C azaltılarak primerlerin daha az sıkı eşleşmelerle bağlanabileceği optimum sıcaklığa kadar düşürülür. Bu şekilde, ilk döngülerde sadece yüksek özgüllüğe sahip bağlanmalar gerçekleşirken, ilerleyen döngülerde amplifikasyon verimliliği artar ve daha fazla primer bağlanabilir. Bu yöntem sayesinde yanlış primerlerin bağlanması engellenirken özgüllüğü yüksek primerlerin bağlanması sağlanarak daha güçlü PCR ürünleri elde edilebilir (4).
Sonuç olarak moleküler biyoloji ve genetik alanında devrim niteliğinde bir buluş olan Polimeraz Zincir Reaksiyonu (PCR), keşfinden bu yana sürekli olarak gelişmekte ve farklı uygulama alanlarında yerini almaktadır. Her geçen gün geliştirilen yeni yöntem ve protokoller sayesinde PCR, tanıdan adli tıbba, tarımdan evrimsel biyolojiye kadar geniş bir yelpazede kullanılmaktadır. Bu teknolojinin daha hassas, hızlı ve spesifik hale getirilmesi yönündeki çalışmalar, bilim dünyasına önemli katkılar sunmaya devam etmektedir. PCR'ın sağladığı bu güçlü altyapı sayesinde, gelecekte genetik analizlerin çok daha erişilebilir, güvenilir ve ekonomik hale gelmesi beklenmektedir. Bu bağlamda, PCR teknolojisinin temellerini ve gelişen çeşitlerini anlamak, günümüz ve gelecek araştırmaları için vazgeçilmez bir bilgi birikimi sunması oldukça önemlidir.
Referanslar
1. Koyun, H., ve Üstün, M. F., (2024). Bioinformatic Comparisons of Some Web-based PCR Primer Design Programs. Hayvan Bilimi ve Ürünleri Dergisi. 7(2), 134-144. https://doi.org/10.51970/jasp.1596993
2. National Library of Medicine (NCBI). https://www.ncbi.nlm.nih.gov.
Erişim Tarihi: 28.06.2025.
3. Atalay, R. Ç., (2002). Neden Biyoinformatik. Avrasya Dosyası, Moleküler Biyoloji ve Gen Teknolojileri Özel, Sonbahar. 8(3), 129-141.
4. Klug, W. S., Cummings, M. R., Spencer, C. A., ve Öner, C., (2009). Genetik kavramlar. Palme Yayıncılık, p. 500-512.
6. Karataş M. Moleküler Biyoloji Nobel Akademik Yayıncılık. (2012), p. 288-290.
7. Colinet, D, J., Kummert, P. Lepoivre and J. Semal., 1994. Identification of distinct potyviruses in mixedly- infected sweetpotato by the polymerase chain reaction with degenerate primers. Phytopathology. 84, 65-69.
8. Levy, L., A. Hadidi and Garsey, S. M. (1992). Reverse transcription-polymerase chain reaction asays for the rapid detection of citrus viroids using multiplex primer sets. Proc. Int. Soc. Citriculture, 2, 800.
9. Santagati, S., Garnier, M., Carlo, P., Violani, E., Picotti, G, B., Maggi, A., (1997). Quantitation of low abundance mRNAs in glial cells using different polymerase chain reaction (PCR)-based methods, Br Res Prot; 217.




Yorumlar