Atom Teorilerinden Atomik Orbitallere: Küçük Parçacıkların Büyük Hikayesi
- Emre Can Buluz

- 3 Nis 2025
- 8 dakikada okunur
Güncelleme tarihi: 10 Haz 2025
Klasik Atom Teorisi
Atom fikri, ilk olarak antik Yunan filozofları tarafından geliştirilmiştir. Leukippos'un, M.Ö. 500 civarında bir atom hipotezi ortaya atan ilk kişi olduğu düşünülmektedir ve bu fikir, Demokritos tarafından büyük ölçüde genişletilmiştir. Dört element teorisini geliştiren büyük filozof Aristoteles, atom fikrine karşıydı çünkü boşluk ilkesini kabul edemiyordu. Aristoteles'in itibarı o kadar büyüktü ki onun görüşü Demokritos'un teorisinin önüne geçmiş ve yaklaşık 2000 yıl boyunca atom teorisi gözden düşmüştür (1).

Bugün bildiğimiz şekliyle atom teorisi, Dalton'un zihninde şekillenmiştir. Dalton, bilimsel çalışmalarına bir meteorolog olarak, atmosferin özelliklerini inceleyerek başlamıştır. Kısmi basınçlar yasasını 1801 yılında yayımladığı bir makalede açıklamıştır (2). Bu yasada, herhangi bir gaz karışımında toplam basıncın, her bir gazın uyguladığı kısmi basınçların toplamı olduğunu ifade etmiştir.
Dalton'un atom teorisine göre:
1. Elementler, atom adı verilen ve bölünemez küçük parçacıklardan oluşur.
2. Belirli bir elementin tüm atomları aynı boyuta ve ağırlığa sahiptir.
3. İki veya daha fazla farklı elementin atomları, bileşikler oluşturmak için birleşir. Belirli bir bileşik, her zaman aynı türdeki atomlardan oluşur ve her tür atomdan her zaman aynı sayıda bulunur.
4. Bir kimyasal reaksiyon, atomların yeniden düzenlenmesi, ayrılması veya birleşmesiyle gerçekleşir. Kimyasal bir reaksiyon sırasında atomlar asla yaratılmaz ya da yok edilmez.
Dalton’un postülatları, 100 yılı aşkın bir süre boyunca kimyanın yol gösterici ilkeleri olarak kalmıştır. Ancak Dalton'un bazı açıklamaları değiştirilmiştir. Artık aynı elementin atomlarının birbirine tamamen özdeş olmadığını ve daha küçük parçacıklardan oluştuğunu biliyoruz. Ancak bir atom hâlâ bir elementin özelliklerini koruyan en küçük parçacık olarak kabul edilir. Atomlar, etrafımızdaki her şeyin yapı taşları olsa da bir atomu ya da milyarlarca atomu çıplak gözle göremeyiz. Ancak milyarlarca atom bir araya geldiğinde her bir atomun özellikleri bir sonraki atomun özellikleriyle birleşir ve elementle ilişkilendirdiğimiz özellikleri görmeye başlarız (3).
19. yüzyılın başlarında bilim insanları gazların, gaz boşaltım tüpleri (katot ışını tüpleri olarak da bilinir) kullanılarak yaptıkları deneylerde elektriği iletebileceğini keşfetmiştir. Bu tüpler, neredeyse tüm gazın vakum altında çıkarıldığı ve ardından mühürlendiği cam tüplerdi. Tüpün her iki ucuna elektrotlar yerleştirilmiş ve elektrotlara akım uygulandığında bir dedektör ekranında parlak bir nokta olarak gözlemlenen yüklü parçacıkların bir demeti (katot ışını) oluşmuştur. 1897'de John J. Thomson, katot ışını tüplerini kullanarak bir deney tasarladı. Bu deneyde, katot ışınının tüpten çıkmasını sağlamak için delikli bir elektrot kullanmış ve katot ışınının, harici yüklü plakalar ve bir manyetik alana maruz bırakıldığında nasıl davrandığını incelemiştir (4). Thomson, plakalar üzerindeki yükleri ve manyetik alanın şiddetini ayarlayarak sapmayı dengelemeyi başarmış ve katot ışınlarını oluşturan parçacıkların yük-kütle oranını hesaplamıştır. Hesapladığı yük-kütle oranları şaşırtıcı derecede büyüktü bu da katot ışınlarındaki parçacıkların kütlesinin çok küçük olduğunu göstermekteydi. Thomson, bu parçacıkları, "hidrojen atomunun kütlesinin önemsiz bir kısmına sahip" olarak tanımlamıştır. Ardından 1904 yılında J.J. Thomson, atomun içinde negatif yüklü parçacıklar olan elektronların yer aldığı pozitif yüklü madde küresinden oluştuğunu öne süren "plum pudding model" (üzümlü kek modeli) olarak adlandırılan bir model önermiştir. Bu model, üzümlerin bir kek içine dağılmış olması gibi bir yapıyı andırıyordu (5) (Şekil 2.).
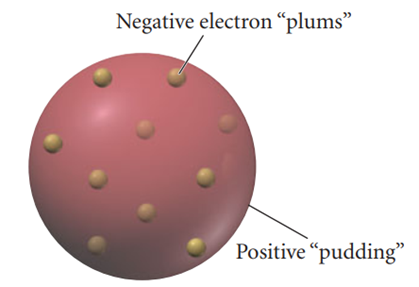
J.J. Thomson’un atom modelinde, atomun temel durumunda elektronlar denge konumlarında sabitlenmiştir ve hiçbir radyasyon yaymazlar. Atomun uyarılmış durumunda ise, elektronlar denge konumları etrafında salınım yapar ve yük taşıdıkları ile sürekli olarak hızlanıp yavaşladıkları için dipol salınımları yoluyla radyasyon yayarlar (6).
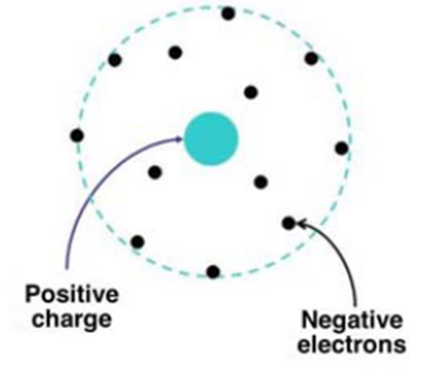
Thomson’un “üzümlü kek” atom modelinin aksine Rutherford’un atom modeline göre atomun tüm kütlesi, pozitif yükün de bulunduğu atom çekirdeğinde yoğunlaşmıştır ve çekirdeğin yarıçapı yaklaşık olarak 10⁻¹⁵ m mertebesindedir. Elektronlar ise atomun çevresinde, yarıçapı yaklaşık 10⁻¹⁰ m olan küresel bir bulut şeklinde dağılmıştır (Şekil 3.).
Rutherford atom modelini ortaya koyabilmek için bir dizi deney gerçekleştirmiştir. Rutherford, alfa parçacıkları (temelde pozitif yüklü parçacıklar) ile bir deney gerçekleştirmiş ve bu parçacıkları ince bir metal folyoya yönlendirmiştir. İlginç bir şekilde bazı alfa parçacıkları, Şekil 4.’te gösterildiği gibi kesik çizgilerle saparken çoğu parçacık, okla gösterildiği gibi folyonun içinden geçmiştir. Bu durumda hem sapan hem de geçen alfa parçacıkları tespit edilmiş oldu. Bu deney sonuçları, alfa parçacıklarının çoğunun metal folyodan geçtiğini ve bunun da ince metalin atomlarının büyük ölçüde boş alana sahip olduğunu doğruladığını göstermektedir (7). Bununla birlikte, alfa parçacıklarının bir kısmının sapması, metal atomlarının küçük ve pozitif yüklü yoğun bir alana sahip olduğunu ortaya koymaktadır (8).
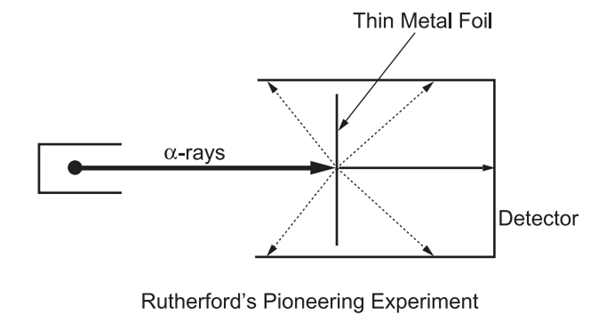
Rutherford’un deneyin ardından bu keşfi ilk duyduğunda tepkisi şu şekilde olmuştur: “Sanki 15 inçlik bir top mermisini incecik bir kağıt mendile fırlatıp, geri dönüp size çarpması kadar inanılmazdı.” Rutherford’un ortaya koyduğu atom modeline göre;
· Atomun büyük bir kısmı boşluktan oluşuyordu bu yüzden çoğu α parçacığı hiç sapmadan geçebilmektedir.
· Atomun pozitif yükü ve kütlesi, çok yoğun ve küçük bir bölge olan çekirdekte toplanmıştır.
· Bir α parçacığı çekirdeğe yaklaştığında güçlü bir itme kuvveti hissediyor ve büyük açılarla saçılabiliyor.
· Eğer bir α parçacığı doğrudan çekirdeğe yönelirse devasa bir itme kuvvetiyle tamamen geri dönebilir.
Daha sonra çekirdekteki pozitif yüklü parçacıklar "proton" olarak adlandırılmıştır. Yapılan diğer deneylerde bir protonun yükünün bir elektronunkine eşit büyüklükte fakat zıt işaretli olduğu ve protonun kütlesinin yaklaşık 1.67262 × 10⁻²⁴ g olduğu yani bir elektronun kütlesinden yaklaşık 1840 kat daha ağır olduğu bulunmuştur (9). Ancak Rutherford’un bu modeli büyük bir teorik sorun yaratmıştır. O dönemde kabul edilen klasik elektromanyetik teoriye göre merkez etrafında dönen bir yüklü parçacık (elektron gibi) sürekli olarak elektromanyetik radyasyon yayarak enerji kaybetmelidir. Bu durumda:
Elektron hızla enerji kaybeder
Spiral bir yol izleyerek çekirdeğe düşer
Atom, saniyenin yaklaşık 10⁻¹⁰'unda çöker.
Bu teori, atomun kararlı bir yapıya sahip olduğunu açıklayamamaktaydı.
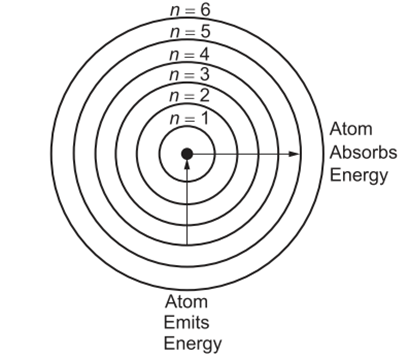
Bu çıkmazı 1913'te Danimarkalı fizikçi Niels Bohr çözmüştür. O dönemde Rutherford ile beraber çalışan Bohr, Max Planck ve Albert Einstein'ın kuantum teorisinden yararlanarak yeni bir atom modeli geliştirmiştir (10). Niels Bohr yaptığı çalışmalarla hidrojen atomunun yayılım spektrumuna teorik bir açıklama getirmiştir (11). Klasik fiziğin yasalarına göre hidrojen atomundaki elektron, çekirdeğe doğru ivmelendiği için elektromanyetik dalgalar şeklinde sürekli enerji yaymalıdır. Bu durumu açıklamak için Bohr, elektronların yalnızca belirli enerji seviyelerinde bulunabileceğini öne sürmüştür. Bohr'un temel varsayımları şunlardır:
· Elektronlar yalnızca belirli enerji seviyelerinde (yörüngelerde) bulunabilir. Enerjileri kuantizedir yani rastgele bir enerji değeri alamazlar.
· Elektron belirli bir yörüngede hareket ederken enerji yaymaz bu nedenle çekirdeğe düşmez.
· Elektronlar enerji soğurduğunda veya yaydığında farklı yörüngelere geçer.
· Daha yüksek enerjili bir yörüngeden daha düşük enerjili bir yörüngeye geçen elektron, bir foton (ışık parçacığı) yayar.
Bu süreç, hidrojen spektrumundaki çizgilerin oluşumunu açıklamaktadır (9).
Bohr, hidrojen atomundaki bir elektronun sahip olabileceği enerji seviyelerinin, aşağıdaki denklemle belirtilebileceğini göstermiştir.
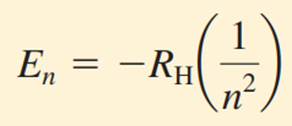
Burada RH Rydberg sabiti (İsveçli fizikçi Johannes Rydberg'in adıyla anılan bir sabittir) ve değeri 2.18×10−18 J’dür. n sayısı, baş kuantum sayısı olarak adlandırılır ve 1, 2, 3 gibi tamsayı değerleri alabilir. Denklemdeki negatif işareti, atom içindeki bir elektronun enerjisinin, çekirdekten sonsuz uzaklıkta bulunan serbest bir elektronun enerjisinden daha düşük olduğunu göstermektedir. Serbest bir elektronun enerjisi sıfır kabul edilir. Matematiksel olarak, bu durum denklemde 𝑛 değerinin sonsuza eşit olarak ayarlanmasına karşılık gelir, yani 𝐸∞=0 olur. Elektron çekirdeğe yaklaştıkça (𝑛 azaldıkça), 𝐸𝑛 değeri mutlak olarak büyür ancak aynı zamanda daha negatif hale gelir. En negatif değer, 𝑛=1 olduğunda elde edilir ve bu durum en kararlı enerji seviyesi anlamına gelir. Bu durum, temel hal (ground state) olarak adlandırılır ve bir sistemin en düşük enerji seviyesini ifade etmektedir. 𝑛=2,3,… değerleri için elektronun kararlılığı azalır. Bu seviyelerin her biri uyarılmış hal (excited state) olarak adlandırılır ve temel halden daha yüksek enerjiye sahiptir. 𝑛 > 1 olan bir hidrojen elektronu uyarılmış durumda kabul edilmektedir (9).
Bohr’un modeline göre her yörüngenin yarıçapı 𝑛2 ile orantılıdır. Bu nedenle, 𝑛=1 den 𝑛=2,3 değerlerine çıkıldıkça yörüngenin yarıçapı hızla büyür. Elektronun bulunduğu enerji seviyesi ne kadar yüksekse elektron çekirdekten o kadar uzaktadır ve çekirdek tarafından o kadar zayıf bir şekilde tutulmaktadır. Bohr’un teorisi, hidrojen atomunun çizgi spektrumunu açıklamamıza olanak tanır. Atom tarafından soğurulan ışınım enerjisi, elektronun daha düşük enerjili bir durumdan (daha küçük 𝑛 değeri) daha yüksek enerjili bir duruma (daha büyük 𝑛 değeri) geçmesine neden olur. Tersine, elektron daha yüksek bir enerji seviyesinden daha düşük bir enerji seviyesine geçtiğinde bir foton şeklinde ışınım enerjisi yayılır.
Kuantum Mekaniği
Kuantum mekaniği, Bohr atom modelinin ötesinde önemli ilerlemeler sağlayan çok daha güçlü bir teoridir. Bohr'un atom modeli hidrojen atomu gibi basit sistemleri açıklamada başarılı olsa da kuantum mekaniği çok daha geniş bir yelpazede doğru ve detaylı açıklamalar sunmaktadır. Schrödinger denklemi, bir hidrojen atomundaki elektronun girebileceği olası enerji durumlarını belirtir ve bunlara karşılık gelen dalga fonksiyonlarını (ψ) tanımlar (12). Bu enerji durumları ve dalga fonksiyonları, bir dizi kuantum sayısı ile karakterize edilir ve bu sayılarla hidrojen atomunun kapsamlı bir modeli inşa edilebilmektedir. Kuantum mekaniği, atomdaki bir elektronu kesin olarak yerini belirleyemeyeceğimizi söylese de elektronun belirli bir zamanda bulunabileceği bölgeyi tanımlar. Elektron yoğunluğu kavramı, bir elektronu atomun belirli bir bölgesinde bulma olasılığını vermektedir. Schrödinger‘in dalga fonksiyonunun karesi (ψ²), çekirdek etrafındaki üç boyutlu uzayda elektron yoğunluğunun dağılımını tanımlamaktadır. Yüksek elektron yoğunluğu bölgeleri, elektronu bulma olasılığının yüksek olduğunu, düşük elektron yoğunluğu bölgeleri ise elektronun bulunma olasılığının düşük olduğunu göstermektedir (9).
Bir atomun kuantum mekaniksel tanımını Bohr modelinden ayırmak için, yörünge yerine atomik orbitaller terimi kullanılmaktadır. Atomik orbital, bir atomdaki elektronun dalga fonksiyonu olarak düşünülebilir. Bir atomik orbital, özgül enerjiye ve elektron yoğunluğunun özgül bir dağılımına sahiptir. Schrödinger denklemi, tek bir proton ve bir elektrona sahip basit hidrojen atomu için gayet iyi çalışırken, birden fazla elektron içeren atomlar için tam olarak çözülememektedir. Fakat kimyagerler ve fizikçiler, bu tür zorlukların üstesinden gelmek için yaklaşık çözümler geliştirmiştir. Örneğin, çok elektronlu atomlardaki (iki ya da daha fazla elektrona sahip atomlar) elektronların davranışı hidrojen atomundakinden farklı olsa da, farkın çok büyük olmadığı varsayılır. Bu nedenle, hidrojen atomundan elde edilen enerji ve dalga fonksiyonları, daha karmaşık atomlardaki elektron davranışlarının iyi yaklaşıkları olarak kullanabilir (9).
Atomik Orbital Tipleri
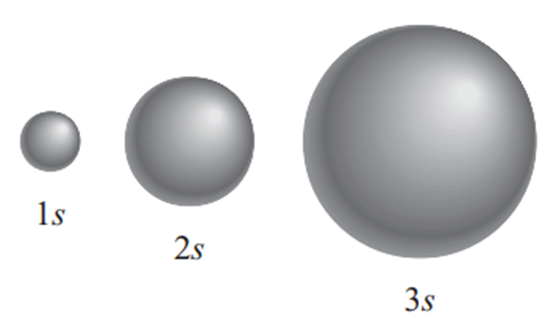
s Orbitali
‘s’ orbitali küresel bir şekle sahiptir. Kürenin merkezi çekirdek olup, belirli bir mesafede elektronlar bulunmaktadır. Bu nedenle baş kuantum sayısı (n) arttıkça, orbitallerin şekli giderek daha büyük hale gelir (8).
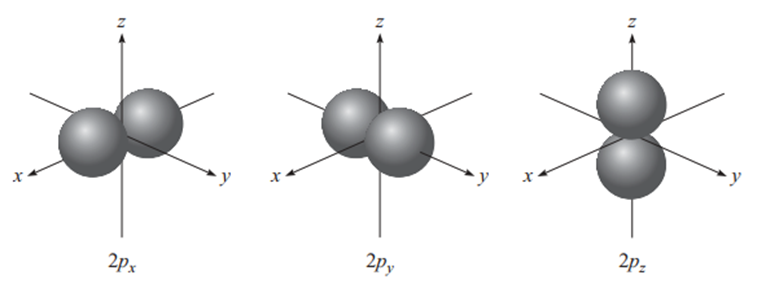
p orbitali
ℓ=1 olduğunda, manyetik kuantum sayısı (mℓ) -1, 0 ve 1 değerlerini alabilir. Bu nedenle, n = 2 ve ℓ=1 olduğunda, 2px, 2py ve 2pz olmak üzere üç adet 2p orbitali oluşur. Harf alt simgeleri, orbitallerin hangi eksenler boyunca yönlendirildiğini gösterir. Bu üç p orbitali, boyut, şekil ve enerji açısından birbirine özdeştir; yalnızca yönelimleri farklıdır (9).
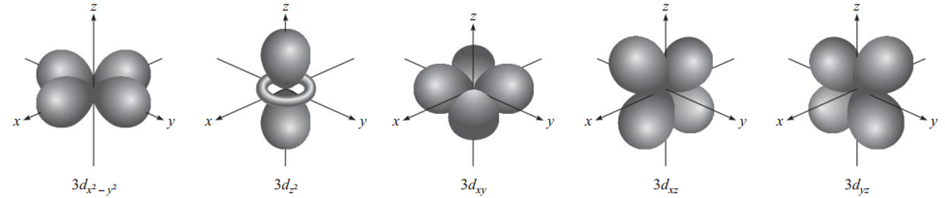
d orbitali
ℓ=2 olduğunda, beş adet (-2, -1, 0, 1, 2) mℓ değeri vardır ve bunlar beş d orbitaline karşılık gelir. Bir d orbitalinin en düşük n değeri 3'tür. Çünkü ℓ, hiçbir zaman n−1'den büyük olamaz, bu yüzden n=3 ve ℓ=2 olduğunda, beş adet 3d orbitali (3dxy, 3dyz, 3dxz, 3dx²-y² ve 3dz²) vardır. p orbitallerinde olduğu gibi, d orbitallerinin farklı yönelimleri, mℓ'nin farklı değerlerine karşılık gelir ancak yine de verilen bir yönelim ile belirli bir mℓ değeri arasında doğrudan bir ilişki yoktur. Bir atomdaki tüm 3d orbitalleri enerjileri açısından birbirine özdeştir. n değeri 3'ten büyük olan d orbitalleri (4d, 5d, ...) benzer şekillere sahiptir (9).
D orbitallerinden daha yüksek enerjiye sahip orbitaller f, g, ... gibi etiketlenir. F orbitalleri, atom numarası 57'den büyük olan elementlerin davranışını açıklamak için önemlidir ancak şekilleri temsil etmek zordur (9).
Atomun yapısı hakkındaki bilgilerimiz, bilimsel gelişmelerle birlikte büyük bir evrim geçirmiştir. Dalton’un atom modelinden başlayarak, Thomson ve Rutherford’un keşifleri ile genişleyen atom anlayışı, Bohr’un kuantum sıçramaları ve modern kuantum mekaniğinin sağladığı dalga fonksiyonlarıyla daha da derinleşmiştir. Günümüzde Schrödinger denklemi sayesinde elektronların olasılık dağılımını tanımlayarak atomik orbitalleri belirleyebiliyoruz. Bu gelişmeler, sadece atomun yapısını anlamamıza yardımcı olmakla kalmamış aynı zamanda kimyadan malzeme bilimine, ilaç geliştirmeden nanoteknolojiye kadar pek çok alanda devrim niteliğinde ilerlemelerin kapısını aralamıştır. Atomun doğasını anlama yolculuğu, bilim insanları için bitmeyen bir keşif süreci olmaya devam etmektedir.
Referanslar
1. Peacocke, T. A. H. (1967). Atomic and Nuclear Chemistry: Atomic Theory and Structure of the Atom. Pergamon.
2. Dalton, John. (1801). Experimental essays, on the constitution of mixed gases; on the force of steam or vapour from water and other liquids in different temperatures, both in a Torricellian vacuum and in air; on evaporation; and on the expansion of gases by heat. Memoirs of the Literary and Philosophical Society of Manchester, 5(2), 535--602. https://www.biodiversitylibrary.org/part/308525
3. Karen C. Timberlake. (2011). Chemistry: An Introduction to General, Organic, and Biological Chemistry (11th Edition). Pearson.
4. Thomson, J. J. (1897). XL. Cathode Rays. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 44(269), 293–316. https://doi.org/10.1080/14786449708621070
5. Susan Young, William Vining, Roberta Day, Beatrice Botch. (2017). General Chemistry Atoms First. Cengage Learning.
6. Podgoršak, E. B. (2006). Rutherford—Bohr Atomic Model. Radiation Physics for Medical Physicists, 42-85.
7. Rutherford, E. (1911). "The Scattering of α and β Particles by Matter and the Structure of the Atom." Philosophical Magazine, 21(125), 669-688. https://doi.org/10.1080/14786440508637080
8. S. Ekambaram. (2012). General Chemistry. Pearson Education India.
9. Raymond Chang, Jason Overby. (2011). General Chemistry: The Essential Concepts. McGraw-Hill.
10. Darrell Ebbing, Steven D. Gammon. (2007). General Chemistry: Media Enhanced Edition. Cengage Learning.
11. Bohr, N. (1913). "On the Constitution of Atoms and Molecules." Philosophical Magazine, 26(151), 1-25. https://doi.org/10.1080/14786441308634955
12. Schrödinger, E. (1926). "Quantisierung als Eigenwertproblem" (Quantization as an Eigenvalue Problem). Annalen der Physik, 79(4), 361-376. https://doi.org/10.1002/andp.19263840404




Yorumlar